Mikrobiologie: Bakterien warten sich selbst
Bestimmte Bakterien bilden komplexe molekulare Strukturen, die wie winzige Maschinen funktionieren, an Nadeln erinnern und ihnen beim Befall von Wirtszellen helfen, indem sie Proteine in diese injizieren – ein wichtiger Schritt bei Infektionen. Forschende des Karlsruher Instituts für Technologie (KIT) haben nun gezeigt, dass beim mit dem Pesterreger verwandten Bakterium Yersinia enterocolitica der innere Membranring des sogenannten Typ-III-Sekretionssystems (T3SS) fortwährend ausgetauscht wird. Dieser Austausch ist entscheidend für die Montage und Funktion des Injektionsapparats. Die Erkenntnisse bieten Potenzial für die Erforschung von antimikrobiellen Behandlungsmethoden.
Neue Dynamik im Injektionsapparat
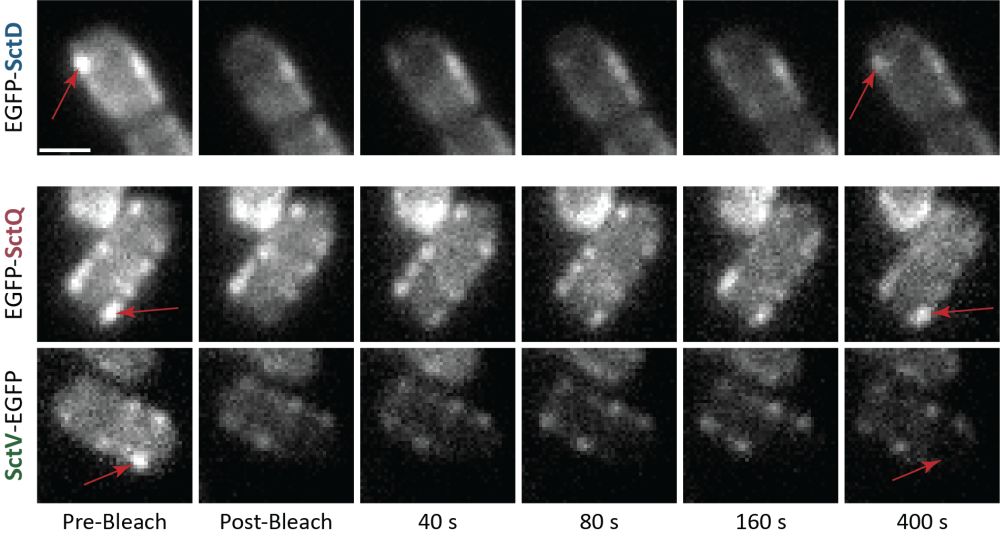
Das Team um Dr. Andreas Diepold vom Institut für Angewandte Biowissenschaften des KIT untersuchte das innere Membranprotein SctD und stellte dabei fest, dass dessen Untereinheiten selbst in vollständig montierten T3SS werden ständig ersetzt werden. „Der Austausch der Ringkomponenten ist zentral für den Betrieb des Sekretionssystems“, erklärt Diepold.
Dass sich zentrale Bauelemente dynamisch ersetzen, macht das System anpassungsfähig und dauerhaft funktionsfähig, was besonders im Infektionskontext relevant ist. Zugleich eröffnet die Dynamik neue Angriffspunkte: Bei einer Störung des Austauschs, lässt sich die Sekretion hemmen. „Das könnte ein potenzieller Ansatz für antimikrobielle Strategien sein“, so Diepold. Das T3SS kann zudem als Werkzeug für die gezielte Injektion von Proteinen dienen.
Künftig wollen die KIT-Forschenden klären, welche molekularen Mechanismen den Austausch von SctD steuern und wie Umweltreize darauf wirken. „Wir stehen hier am Anfang eines neuen Verständnisses dafür, wie bakterielle Nanomaschinen nicht nur aufgebaut, sondern auch mobil und anpassungsfähig bleiben“, so Diepold.
mfe, 20.11.2025
Foto:
Um den Austausch von SctD (oben) zu zeigen, haben die Forschenden eine Variante des Proteins markiert (roter Pfeil). Das Wiederauftreten der Markierung zeigt, dass das Protein ausgetauscht wurde – ähnlich wie beim dynamischen Protein SctQ (Mitte), aber nicht beim stabil eingebauten SctV (unten).