Wie Fibrose elektrische Signale des Herzens stört
Herzfibrose kann lebensbedrohlich sein: Durch die Bildung von Bindegewebe im Herzmuskel wird dieser steif, die elektrische Signalweiterleitung gestört und die Pumpleistung geschwächt, dazu können Herzrhythmusstörungen auftreten. Doch die Auswirkungen der Herzfibrose auf die elektrische Leitfähigkeit des Herzens waren bisher unzureichend erforscht. Diese Lücke hat nun ein Forschungsteam unter der Leitung der Universität Freiburg mit Beteiligung des Karlsruher Instituts für Technologie (KIT) geschlossen, neue Erkenntnisse über die Grundlagen der Elektrophysiologie bei Herzfibrose gewonnen und damit weitere Möglichkeiten für personalisierte Diagnose- und Therapieansätze eröffnet.
Computermodelle und digitale Zwillinge
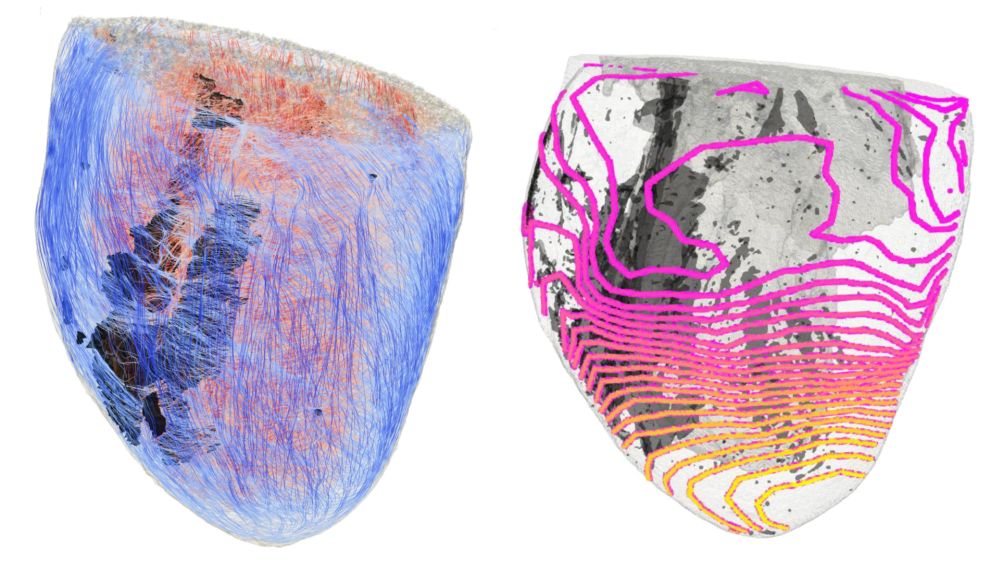
Die Forschenden fanden mithilfe von optischer Bildgebung und 3D-Computermodellen von Mäuseherzen heraus, dass fibrotisches Gewebe wie ein „Tiefpassfilter“ auf die elektrische Signalverbreitung im Herzen, also die Elektrophysiologie, wirkt: Durch die verlangsamte oder blockierte Weiterleitung elektrischer Impulse bei einem höheren Puls, beispielsweise durch körperliche Anstrengung, kann es zu gefährlichen Herzrhythmusstörungen kommen – so auch bei der arrhythmogenen Kardiomyopathie, die besonders bei jungen Menschen vorkommt. Für die Diagnostik bei Risikopatientinnen und -patienten sind daher gezielte Belastungstests wichtig.
„Zum ersten Mal ist es uns gelungen, den Einfluss von Bindegewebe, das mit den Herzmuskelzellen zusammenwirkt, bei der arrhythmogenen Kardiomyopathie zu entschlüsseln“, erklärt Dr. Francesco Giardini von der Universität Freiburg. Die Forschungsgruppe „Computermodelle des Herzens“ um Dr. Axel Loewe vom KIT hat die experimentellen Daten in Computersimulationen integriert, einen digitalen Zwilling des biologischen Experiments entwickelt und damit die gestörte Erregungsweiterleitung bei hohen Herzraten aufgezeigt. „Wir wollen die Methode auf größere Tiermodelle und Modelle des menschlichen Herzens ausweiten, um digitale Zwillinge für die Präzisionskardiologie weiterzuentwickeln und so die klinische Diagnostik und Behandlung verbessern“, so Loewe.
lkr, 07.10.2025